|
「主な対象読者」
 中学校の高学年生から大学院生くらいまでの幅広い年齢層を読者の対象と考えています。 中学校の高学年生から大学院生くらいまでの幅広い年齢層を読者の対象と考えています。
「著者からの希望」
病気の原因となる病原体についての研究は、これまで微生物学(広い意味での生物学)の専門家の独壇場であったようです。しかし、病原体の種類、大きさや物性などが多岐にわたるようになるにつれて、病原体の性状、突然変異や病気の発症の研究には、医学者や生物学者だけでなく、「化学、物理学や分子科学など」の専門家の力が絶対的に必要となってきています。この著作「ナノテクノロジー、医療と分子科学」は、この新しい科学に対して若い人が興味を持つキッカケとなり、将来を担う研究者や技術者が現れることを期待して、分子科学の分野からまとめたものです。
本 文 目 次
著作 宇理須 恒夫
第40話 ナノテクノロジー、医療と分子科学
1.近代細菌学のはじまり
紀元前から数々の戦争の舞台となった地中海の港町で1347年9月突然珍しい病気が発生しました。発病から瞬く間に患者は肌が黒紫色に変色して死んでしまいました。このことからこの病気は黒死病と呼ばれました。
この病気はこれでおさまらず、瞬く間にヨーロッパ中に広がり、1350年に一応の終結を見るまでに、ヨーロッパの人口の1/4が死亡してしまいました。これによる出生率の低下の影響も含めると実質的に1/3の人口が減ってしまいました。
人々は恐れおののいて、神の怒(いか)りを感じ、悔恨の行列を組み、鞭(むち)で自分の体をたたいたそうです。治療法も予防法も知れず、ひたすら祈り、そして死体や患者を遠ざけ、 ところによってはユダヤ人を病気をまきちらした張本人として血祭りにあげた所もありました。
この病気こそ、後世 ペストとよばれる病気で、この後も色々なところで流行し多くの人々が亡 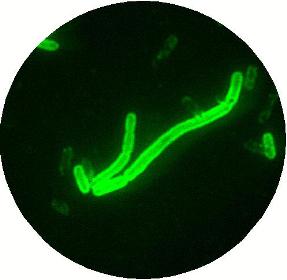 くなりました。
この病気の病原体は(図1)、大きさ1?3ミクロンほどの細菌で、日本人の北里柴三郎とフランスのアレキサンドル・エルサンがほぼ同時期(1894年)に発見したとされています。
この時期は沢山の病原菌が発見された時代です。コッホによる結核菌、コレラ菌の発見(それぞれ、1882年、1884年、但しコレラ菌については後に1854年にフィリッポ・パッチーニが発見した菌と同じものであることが確認されました)、志賀潔による赤痢菌の発見(1897)などです。
 いわゆる近代細菌学が誕生した医学史における 黄金期の時期のように思われます。これらの細菌の発見は、すべて 光学顕微鏡でなされました。
北里柴三郎の先生でもあるローベルト・コッホは、ゲッチンゲン大学を1866年に卒業して医師となりましたが、意外なことに、出発は大學での研究ではなく、奥様の希望によって田舎で開業医として出発したのでした。そこで、第28回目の誕生日を迎えた時、夫人が顕微鏡を最愛の夫に誕生祝に贈ったのが、コッホの研究のはじまりというのも、ユニークです。
ではこのような病気の治療法はいつ、どのようにして開発されたのでしょうか。ペストの治療法を調べますと、抗菌剤が有効とあります。抗菌剤というのは、人工合成で作られる抗生物質のことです。
抗生物質は、アレキサンダー・フレミングによって1929年青カビから単離されたペニシリンが最初です。フレミングがインフルエンザの研究中にブドウ球菌の培養皿に偶然落ちたカビがその周囲だけ菌の発育を抑えているのを発見し、その原因となっている物質をペニシリンと名付けました。
この抗生物質の発見が、結核などの細菌感染による病気が不治の病からそれほど恐ろしくない病気へかわるブレークスルーとなりました。ただペニシリンは不安定な物質で単離することが困難ですぐには有効活用することができませんでした。この夢の薬の実用化が実現したのは、フローリーとチェーンが苦労の末1940年単離に成功してからです。フレミング、フローリー、チェーンの3人は1945年ノーベル生理学医学賞を受賞しました。
2.光学顕微鏡の限界とウイルスの発見
さて、このような細菌学の発展のいきおいから、まだ病原菌が発見されていない病気も顕微鏡を用いて発見されるのも時間の問題だと考えられていました。このような考えに関して有名なのが野口英世の黄熱病の研究ではないでしょうか。
米国ロックフェラー研究所にいた時、野口英世は黄熱患者の血液にレプトスピラという微生物を発見しましたが、アードリアン・ストークスの研究発表で,アフリカの黄熱にはレプトスピラを証明できない、黄熱の病原体は細菌の濾過器を通過する濾過性病毒だという発表を聞き、自説を証明するためアフリカに渡りました。
やがて彼はみずからの説の誤りを認めることになるのですが、不幸にも帰国直前に黄熱病に感染し病死してしまったことは良く知られています。この濾過生病毒こそが、後にウイルスとして呼ばれるあらたな病原体なのです。
このころ同様な病原体の存在は他でも確認されはじめていました。1892年タバコモザイク病の病原体が濾過器を通過しても感染性を失わないことをロシアのデイミトリ・イワノフスキーが発見し、濾過性病原体と呼ばれました。また、1898年にはドイツのフリードリッヒ・レフラーとポール・ロッシュが口蹄疫の病原体の分離を試み、これが同じような存在であることを突き止めました。
同じ年に、オランダのマルテイヌス・ベイエリンクはイワノフスキーと同様な研究を行い、この未知の性質を持つ病原体を“生命を持った感染性の液体”と呼び、この病原体が分子であると考え、分子が細胞に感染して増殖すると主張しました。
1935年にアメリカのウエンデル・スタンレーがタバコモザイクウイルスの結晶化に成功し、この結晶が感染能を持っていることを示しました。化学物質のように結晶化できる生物の存在がはじめて示されたのです。スタンレーはこの発見で1946年のノーベル化学賞を受賞しました。
3.電子顕微鏡の発明とナノテクノロジーを利用した医学の始まり
ウイルスという病原体の存在が確認されたことで、これによる多くの疾患に対する治療法が飛躍的に発展しましたが、その研究において、丁度光学顕微鏡が感染症の細菌の研究で大活躍したように、電子顕微鏡の発明が大きく貢献しています。
光学顕微鏡では、可視光線を利用する限り、分解できる2点の距離(空間分解能)が約200nm(1nm=1ナノメーター=10億分の1m)よりも小さくなることは理論上あり得ないことが言えます。ウイルスは10-100nmの大きさですので、細胞を濾過する濾過器をすり抜けてしまい、また、光学顕微鏡ではとらえることができなかったことが、多くの細菌学者に苦難な結果を味わわせた理由だったわけです。
電子顕微鏡は1931年ベルリン工科大学のマックス・クノールとエルンスト・ルスカによって発明され、その後シーメンス社に招聘されたルスカらによって実用装置の開発が進められました。ルスカはこの功績で1986年ノーベル物理学賞を受賞しました。
電子顕微鏡の解像度は装置の性能だけでなく取り扱う人の腕前にもよりますが、素人でも10nmくらいは容易に解像できるので、ウイルスの像を出すのは、特殊な染色技術を必要とすることは別の問題として、比較的容易なことになったわけです。
ウイルスは感染とか増殖という生物の性質を持つと同時に、タンパク質とDNAあるいはRNAだけから構成されており、物質という側面をも持っている、生物と物質の中間の存在なわけです。
即ち、ウイルスの発見は医学と物質科学の境界が無くなった瞬間だったと言えるわけです。この時代にはまだナノテクノロジーという言葉は無かったのですが、今から考えると、まさにナノテクノロジーが医学に必須の存在となる走りだったわけです。
4.第三の病原体の出現
さてここで、ちょっと面白いグラフを見てみましょう。図2のグラフは縦軸が寸法で横軸がその病原体や計測技術あるいは大発見が行われた年代となっています。同時に20世紀後半にナノテクノロジーの発展に直接寄与した半導体素子の微細化の進展をプロットしてあります。
このグラフでは細菌、ウイルス、に続く“第三の病原体”ともいえるプリオンが配置してあります。プリオンは近年騒がれている狂牛病の病原体と考えられています。
プリオンには正常なプリオンと異常なプリオンがあって、正常なプリオンは平素の健康な人の脳の神経細胞の表面に存在しているもので、その役割は完全には分かっていませんが重要な役割を担っているらしいことは確かなようです。
発病のメカニズムも不明な点が多く治療法も不明です。異常なプリオンに感染すると、正常なプリオンも異常となり脳の神経細胞を破壊してしまいます。感染すると100%が死亡するという難病中の難病です。
ウイルスは遺伝子を持っておりちょっとは生命体の顔をしているのですが、プリオンは純粋なタンパク質で物質の顔しかしていません。しかし、感染という生命体の顔をチラと見せるわけです。
この、細菌、ウイルスにつぐ“第三の分類に属する病原体”ともいえるものには、他にも、アルツハイマーのベータアミロイドというタンパクがありますが、これについては、まだ本当に病原体なのかどうかすらわかっていません。
しかし、アルツハイマーの患者数は世界中で4000万人くらいと膨大な数にのぼり、その悲惨さと合わせて、細菌が発見される以前のペストやコレラに匹敵する疾患であると言えます。
ウイルスの多くは病原体そのものが発見されており病気の原因が判明していますが、その治療法となると、エイズのようにまだ完璧なものが見つかっていない状況です。
即ち、図2の表から、病気の原因が小さくなればなるほど、言い換えれば、病原体が物質に近づけば近づくほど、病気の原因や治療法が混沌としてくることが分かります。
もう一つ図2の表は発見される病原体の年代に対する勾配がナノテクノロジーの微細化限界の勾配と良く合っていることです。これは人類が病気との闘いにおいて、自分たちの利用できる極限の技術をいつの時代も駆使して必死に格闘していることを意味しています。
即ち、これからは病気の原因の解明や治療法の開発においてナノテクノロジーが大活躍することを意味しています。
さて、このように分類しますと、分子の科学が第三の病原体の発見やその性質の研究に重要そうなことが何となく分かりますが、そのことをもっと明確に示す最近の私たちの研究の成果の一部を紹介しましょう。
5.新しい“生体内での分子の科学”のはじまり
アルツハイマー病の進行については、ベータアミロイドが神経の細胞膜の表面で凝集し膜を破壊して神経細胞を死なせてしまうという機構があるのではないかと考えられています。
また、細胞膜は脂質二重膜で構成されているのですが、特に神経細胞のシナプスという情報伝達で重要な役割をする部分に沢山存在すると言われている、ガングリオシドGM1という脂質分子の一種がこの凝集が始まるきっかけ、“種”を作るのに重要な役割をしているのではないかと言われています。このことを発見したのは、柳澤勝彦さん、井原康夫さんなどの日本人です。
そこで私たちは、シナプス表面の脂質二重膜の重要な成分といわれている、ガングリオシドGM1とスフィンゴミエリンとコレステロールを混ぜ合わせた人工の細胞膜を平坦な固体の基板の表面に作り、これにベータアミロイドを含む緩衝液をふりかけ細胞膜の表面構造がどのように変化するかを原子間力顕微鏡で調べることにしました。
原子間力顕微鏡は大気中は勿論、水中でも固体や場合によっては液体もその表面の凹凸を1?10nmの分解能で測定することのできる顕微鏡です。
その結果、たしかにガングリオシドGM1があるとベータアミロイドの凝集が急速に始まるのですが(図3)、最近、固体基板としてシリコンの板を用いた場合と雲母の板を用いた場合でその凝集速度が大きく異なることを見出しました。
現在まだその詳しいメカニズムは不明なのですが、一つの可能性として言えることは、ガングリオシドGM1がベータアミロイドを凝集させやすい構造とそうでない構造をもっているのではないかと言うことです。
実際、ガングリオシドGM1の分子構造を調べますと、図4のように中央でおれまがりやすい構造をしています。即ち周辺のほかの脂質分子との混ざり具合がことなってガングリオシドGM1がベータアミロイドを凝集させやすい構造に変化するのではないかと言うことが考えられるわけです。
私たちの研究はまだ、アルツハイマー病の原因を解明したなどと軽率に言える段階ではありませんが、この結果は、プリオンと同様に、“第三の病原体”の探索には分子構造の詳細な解明が重要であることを示唆しているのではないかと思います。
現段階の私たちの研究の弱点は本当の生体内での観察をしていないことです。病気の研究と言うからには最終的に生体内でどうなっているかということが重要です。その観点からすると、第三の病原体”の探索には生体内での分子構造の詳細な解明が重要であると言えます。即ち、“生体内分子科学”とでも言う新しい分子科学の研究領域の開拓が必要です。
現段階では分子科学者は生体内の分子の構造を観察する十分な手法を持っていません。丁度ウイルスの研究に電子顕微鏡の発明が大きく貢献したように、分子科学者は生体内での分子構造を研究する手法の開拓から取り組む必要があると考えます。
言うは易く行うは難い研究ですが、現在何千万人という人が苦しんでいる難病の原因や治療法の開発につながると思うと大きな夢に満ちた研究領域であることは疑いの余地がありません。
おススメ著書
「ナノテクのためのバイオ入門」(共立出版)、
「ナノテクの医療応用 ナノメディシン」(オーム社)
平成20年1月11日
著作者:宇理須 恒雄
(うりす つねお)
自然科学研究機構
分子科学研究所
総合研究大学院大学・教授
|